2024台山一中高三第一次月考化学试题及答案解析
2023-09-20 16:08:10文/王莹![]()
![]()
![]() 台山一中2024届高三第一次月考
台山一中2024届高三第一次月考
化学科试题 2023-08
说明:本次考试75分钟,共20道题,满分100分
可能用到的相对原子用量:H-1 C-12 N-14 O-16 Cl-35.5
一、选择题:本题共16小题,共44分。第1-10小题,每小题2分;第11-16小题,每小题4分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1. 文物记载着中华文明的灿烂成就,下列文物主要由合金材料制成的是 ( )
文物 |
|
|
|
|
选项 | A.圆雕玉舞人 | B.透雕重环玉佩 | C.朱雀青铜顶饰 | D.炫纹贯耳瓷壶 |
2.高分子材料在生产生活中应用广泛。下列说法错误的是
A.芦苇可用于制造黏胶纤维,其主要成分为纤维素
B.聚氯乙烯通过加聚反应制得,可用于制作不粘锅的耐热涂层
C.淀粉是相对分子质量可达几十万的天然高分子物质
D.大豆蛋白纤维是一种可降解材料
3.下列过程没有发生化学反应的是( )
A.用活性炭去除冰箱中的异味
B.用热碱水清除炊具上残留的油污
C.用浸泡过高锰酸钾溶液的硅藻土保鲜水果
D.用含硅胶、铁粉的透气小袋与食品一起密封包装
4.工业上由石英砂(主要成分为![]() )制备高纯硅的过程中涉及反应:
)制备高纯硅的过程中涉及反应:![]() ;
;![]() ,下列说法正确的是 ( )
,下列说法正确的是 ( )
A.![]() 的球棍模型为
的球棍模型为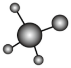 B.28g晶体硅中含有2molSi-Si键
B.28g晶体硅中含有2molSi-Si键
C.HCl中化学键为s-sσ键 D.碳的同素异形体金刚石和![]() 均属于共价晶体
均属于共价晶体
5.宏观辨识与微观探析是化学学科核心素养之一。下列物质性质实验对应的反应方程式书写正确的是 ( )
A.![]() 放入水中:
放入水中:![]()
B.![]() 通过灼热铁粉:
通过灼热铁粉:![]()
C.铜丝插入热的浓硫酸中:![]()
D.![]() 通入酸性
通入酸性![]() 溶液中:
溶液中:![]()
6.下列除杂试剂选用正确且除杂过程不涉及氧化还原反应的是
| 物质(括号内为杂质) | 除杂试剂 |
A | FeCl2溶液(FeCl3) | Fe粉 |
B | Cl2(HCl) | H2O、浓H2SO4 |
C | NaCl溶液(MgCl2) | NaOH溶液、稀HCl |
D | NO(NO2) | H2O、无水CaCl2 |
7.对下列粒子组在溶液中能否大量共存的判断和分析均正确的是
| 粒子组 | 判断和分析 |
A |
| 不能大量共存,因发生反应 |
B |
| 不能大量共存,因发生反应:
|
C |
| 能大量共存,粒子间不反应 |
D | AlO2-、Na+、K+、HCO3- | 能大量共存,粒子间不反应 |
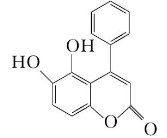 8.我国科技工作者发现某“小分子胶水”(结构如图)能助力自噬细胞“吞没”致病蛋白。
8.我国科技工作者发现某“小分子胶水”(结构如图)能助力自噬细胞“吞没”致病蛋白。
下列说法正确的是 ( )
A.该分子中所有碳原子一定共平面
B.1 mol该物质最多能与3 mol NaOH反应
C.该分子能与蛋白质分子形成氢键
D.该物质能发生取代、加成和消去反应
![]() 9.
9.![]() 常用作食盐中的补碘剂,可用“氯酸钾氧化法”制备,该方法的第一步反应为
常用作食盐中的补碘剂,可用“氯酸钾氧化法”制备,该方法的第一步反应为
6I2 +11KClO3 + 3H2O === 6KH(IO3)2 + 5KCl + 3Cl2↑。下列说法错误的是 ( )
A.产生22.4L(标准状况)![]() 时,反应中转移
时,反应中转移![]()
B.反应中氧化剂和还原剂的物质的量之比为11:6
C.可用石灰乳吸收反应产生的![]() 制备漂白粉
制备漂白粉
D.可用酸化的淀粉碘化钾溶液检验食盐中![]() 的存在
的存在
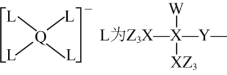 10. 某种镁盐具有良好的电化学性能,其阴离子结构如下图所示。W、X、Y、Z、Q是核电荷数依次增大的短周期元素,W、Y原子序数之和等于Z,Y原子价电子数是Q原子价电子数的2倍。下列说法错误的是 ( )
10. 某种镁盐具有良好的电化学性能,其阴离子结构如下图所示。W、X、Y、Z、Q是核电荷数依次增大的短周期元素,W、Y原子序数之和等于Z,Y原子价电子数是Q原子价电子数的2倍。下列说法错误的是 ( )
A. 第一电离能![]() B.W与X的化合物存在氢键
B.W与X的化合物存在氢键
C. Q的氧化物是两性氧化物 D. 该阴离子中含有配位键
11.芬顿法常用于废水的处理,反应为:NH4OCN+3H2O2= N2↑+ CO2↑+ 5H2O,设NA为阿伏伽德罗常数,下列有关说法不正确的是 ( )
A.H2O2 存在极性共价键和非极性共价键
B.18g H2O 中含有中子数目为 8NA
C.标准状况下,22.4L CO2 中含有σ键数目为 2NA
D.1mol NH4OCN 参与反应时转移电子数为 3NA
12.下列实验过程能达到实验目的的是 ( )
选项 | 实验目的 | 实验过程 |
A | 检验某铁的氧化物含二价铁 | 将该氧化物溶于浓盐酸,滴入KMnO4溶液,紫色褪去 |
B | 检验乙醇中含有水 | 用试管取少量的乙醇,加入一小块钠,产生无色气体 |
C | 证明酸性:H2SO3>HClO | 在Ca(ClO)2溶液中通入SO2气体,观察是否有沉淀生成 |
D | 证明CO2有氧化性 | 将点燃的镁条,迅速伸入盛满CO2的集气瓶中,产生大量白烟且瓶内有黑色颗粒产生 |
13. 陈述I和陈述Ⅱ均正确且具有因果关系的是 ( )
选项 | 陈述I | 陈述Ⅱ |
A | 用FeCl3溶液刻蚀铜质电路板 | 氧化性:Fe3+>Cu2+ |
B | 用Na2O2作呼吸面具的氧气来源 | Na2O2能氧化CO2 |
C | 用Na2S除去废水中的Cu2+和Hg2+ | Na2S具有还原性 |
D | 用石灰乳脱除烟气中的SO2 | SO2具有氧化性 |
14.电解废旧锂电池中的![]() 示意图如下(其中滤布的作用是阻挡固体颗粒,但离子可自由通过。电解过程中溶液的体积变化忽略不计)。下列说法正确的是 ( )
示意图如下(其中滤布的作用是阻挡固体颗粒,但离子可自由通过。电解过程中溶液的体积变化忽略不计)。下列说法正确的是 ( )
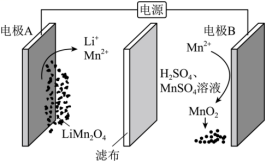
A.电极A的电极反应为:![]()
B.电极B为阳极,发生还原反应
C.电解结束,溶液的![]() 增大
增大
D.电解一段时间后溶液中![]() 浓度减小
浓度减小
15. 我国科技工作者利用计算机模拟N2在不同催化剂,以及硫酸作电解质溶液的条件下,电解还原制备氨气反应历程中相对吉布斯自由能变化如图所示(*代表微粒吸附在催化剂表面)。下列说法错误的是 ( )
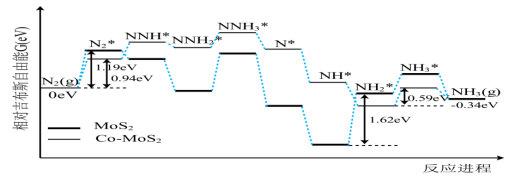
A. 该反应历程在阳极发生 B. 该反应历程实现了人工固氮
C. 从热力学趋势来说该反应能自发进行 D. 该历程的总反应为![]()
16.天然溶洞的形成与水体中含碳物种的浓度有密切关系。已知Ksp(CaCO3)=10-8.7,某溶洞水体中lgc(X)(X为![]() 、
、![]() 或Ca2+)与pH变化的关系如图所示。下列说法不正确的是 ( )
或Ca2+)与pH变化的关系如图所示。下列说法不正确的是 ( )
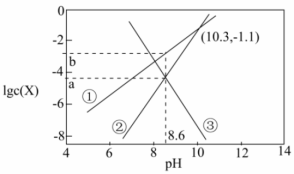
A.曲线①代表HCO![]() ,曲线③代表Ca2+ B.a=-4.35,b=-2.65
,曲线③代表Ca2+ B.a=-4.35,b=-2.65
C.由图中的数据计算得Ka2(H2CO3)=10-10.3 D.pH=10.3时,c(Ca2+)=10-6.5mol•L-1
二、非选择题:本题共4小题,共56分。
17.按要求填空(14分)
(1)①基态镓(Ga)原子的核外电子排布式为_________________________________
②SO3分子VSEPR_______________
(2)向新制Cu(OH)2的悬浊液滴加少量乙醛,并加热,写出其反应化学方程式:__________________
(3)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3与KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为:
(4)将ClO2通入到硫化氢溶液中,然后加入少量的稀盐酸酸化的氯化钡溶液,发现有白色沉淀生成,写出二氧化氯与硫化氢溶液反应的离子方程式:
(5)H3PO2是一元中强酸,H3PO2及NaH2PO2均可将溶液中的Ag+还原为银,从而可用于化学镀银。利用H3PO2进行化学镀银的反应中,氧化剂与还原剂的物质的量之比为4∶1,则氧化产物为________(填化学式)。
(6)联氨(N2H4)是一种常用的还原剂。其氧化产物一般为N2。联氨可用于处理高压锅炉水中溶解的氧,防止锅炉被腐蚀。理论上1.0 kg的联氨可除去水中溶解的O2___________kg。
(7)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。ClO2的有效氯含量为_____________。(计算结果保留两位小数)
18(14分).某小组探究卤素参与的氧化还原反应,从电极反应角度分析物质氧化性和还原性的变化规律。
(1)浓盐酸与MnO2混合加热生成氯气。氯气不再逸出时,固液混合物A中仍存在盐酸和MnO2。
①反应的离子方程式是_____________________________________________。
②电极反应式:
ⅰ.氧化反应:2Cl--2e-===Cl2↑
ⅱ.还原反应:______________________________________。
③根据电极反应式,分析A中仍存在盐酸和MnO2的原因。
ⅰ.随c(Cl-)降低,Cl-还原性减弱或Cl2的氧化性增强。
ⅱ.随c(H+)降低或c(Mn2+)浓度升高,_____________________。
④补充实验证实了③中的分析(下面表格)。
a是 ,b是 。
| 实验操作 | 试剂 | 产物 |
Ⅰ |
| 较浓H2SO4 | 有氯气 |
Ⅱ | a | 有氯气 | |
Ⅲ | a+b | 无氯气 |
(2)利用c(H+)浓度对MnO2氧化性的影响,探究卤素离子的还原性。相同浓度的KCl、KBr和KI溶液,能与MnO2反应所需的最低c(H+)由大到小的顺序是 。
(3)根据(1)中结论推测:酸性条件下,加入某种化合物可以提高溴的氧化性,将Mn2+氧化为MnO2。经实验证实了推测,该化合物是 。
(4)综合上述,可以得到物质氧化性和还原性变化的一般规律:
氧化剂(还原剂)的浓度越大,其氧化性(还原性)越强;还原产物(氧化产物)的浓度越大,氧化剂(还原剂)的氧化性(还原性)越小
据此,小组分别利用电解池(图1)和原电池(图2)装置,成功实现了铜与稀硫酸制氢气。
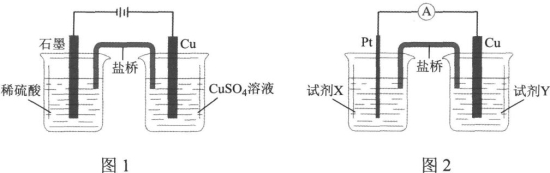
结合上述的探究结论,图2中试剂X是 ,试剂Y是 。(限选试剂:稀硫酸、Na2SO4溶液、NaOH溶液、NaNO3溶液、CuSO4溶液,浓度均为1.0 mol·L-1)
19.(14分)锗(Ge)是门捷列夫在1871年所预言的元素“亚硅”,高纯度的锗已成为目前重要的半导体材料,其化合物在治疗癌症方面也有着独特的功效。下图是以锗锌矿(主要成分为![]() 、ZnS,另外含有少量的
、ZnS,另外含有少量的![]() 等)为主要原料生产高纯度锗的工艺流程:
等)为主要原料生产高纯度锗的工艺流程:
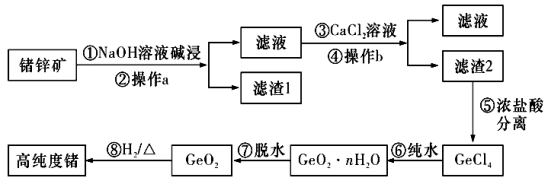
已知:![]() 可溶于强碱溶液,生成锗酸盐。
可溶于强碱溶液,生成锗酸盐。![]() 的熔点为
的熔点为![]() ℃,沸点为84℃,在水中或酸的稀溶液中易水解。
℃,沸点为84℃,在水中或酸的稀溶液中易水解。
(1)Ge位于ⅣA族,属于_________区,![]() 晶体所属类别是______________。
晶体所属类别是______________。
(2)步骤①NaOH溶液碱浸时发生的离子反应方程式为____________________________。
(3)步骤③沉锗过程中,当温度为90℃,pH为14时,加料量(![]() 质量比)对沉锗的影响如表所示,选择最佳加料量为____________(填“10-15”“15-20”或“20-25”)。
质量比)对沉锗的影响如表所示,选择最佳加料量为____________(填“10-15”“15-20”或“20-25”)。
编号 | 加料量( | 母液体积 (mL) | 过滤后滤液含锗(mg/L) | 过滤后滤液pH | 锗沉淀率 (%) |
1 | 10 | 500 | 76 | 8 | 93.67 |
2 | 15 | 500 | 20 | 8 | 98.15 |
3 | 20 | 500 | 2 | 11 | 99.78 |
4 | 25 | 500 | 1.5 | 12 | 99.85 |
(4)步骤⑤中选择浓盐酸而不选择稀盐酸的原因是________________________________。
(5)步骤⑥的化学反应方程式为________________________________________________。
(6)Ge元素的单质及其化合物都具有独特的优异性能.请回答下列问题:
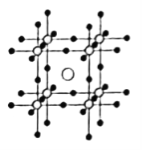
①量子化学计算显示含锗化合物![]() 具有良好的光电化学性能。
具有良好的光电化学性能。![]() 是
是![]() 的量子化学计算模型,
的量子化学计算模型,![]() 的晶体结构如图所示,若设定图中体心钙离子的分数坐标为
的晶体结构如图所示,若设定图中体心钙离子的分数坐标为![]() ,则分数坐标为
,则分数坐标为![]() 的离子是__________。
的离子是__________。
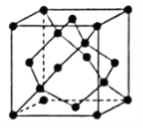
②晶体Ge是优良的半导体,可作高频率电流的检波和交流电的整流用。如图为Ge单晶的晶胞,设Ge原子半径为r pm,其中晶胞体对角线长度为8r pm,阿伏加德罗常数的值为![]() ,则该锗晶体的密度计算式为(不需化简)
,则该锗晶体的密度计算式为(不需化简)![]() ______________________
______________________![]() 。(已知相对原子量:Ge 73)
。(已知相对原子量:Ge 73)
20.(14分)
丹参酮系列化合物是中药丹参的主要活性成分,具有抗菌消炎、活血化瘀、促进伤口愈合等多种作用,其衍生物J的合成路线如下:
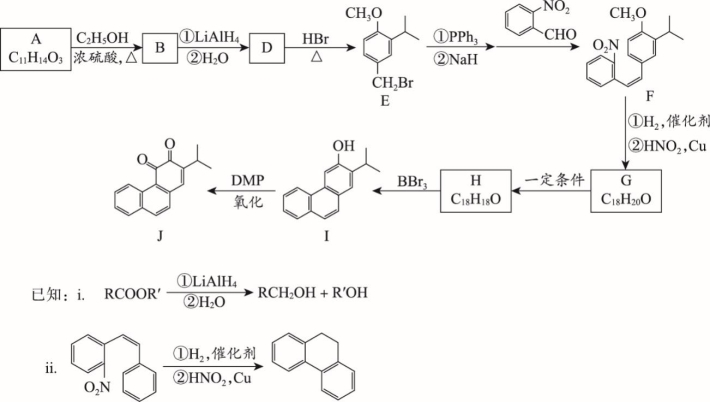
(1)E中含有的官能团名称:________________。
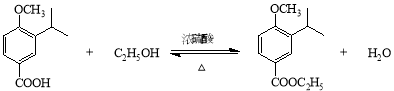
(2)A→B的化学方程式为____________________________________________________。
(3)D→E的反应类型为___________________。
(4)下列关于化合物B、D的说法正确的是_______(填字母序号)。
a.D含有手性碳原子
b.B和D均能使酸性KMnO4溶液褪色
c.B和D在水中的溶解性:B > D
d.B的一种同分异构体含有苯环和碳碳双键,且1 mol该异构体能与3 mol NaOH反应
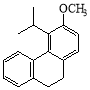
(5)由F制备G的反应中,同时会生成一种副产物G’,它与G互为同分异构体,G’的结构简式为________________。
(6)已知I→J反应过程中1 mol DMP可得2 mol电子,则反应中I与DMP的物质的量之比为______。
(7)丹参酮IIA的合成过程中有如下转化,已知X含三种官能团,不与金属Na反应放出H2,丹参酮IIA分子中所有与氧原子连接的碳均为sp2杂化。
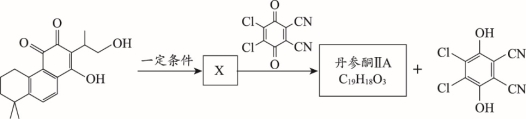
写出X的分子式:___________;丹参酮IIA的结构简式:_________________。
台山一中2024届高三第一次月考化学
参考答案
1-5:CBABD 6-10:CBCAB 11-16:DDACAD
17(14分,除有说明外,每空2分).
![]() (1)①1s22s22p63s23p63d104s24p1 1分 ②平面三角形 1分
(1)①1s22s22p63s23p63d104s24p1 1分 ②平面三角形 1分
(2)CH3CHO+2Cu(OH)2+NaOH →CH3COONa+Cu2O↓+3H2O 2分
(3)2Fe(OH)3+3ClO-+4OH-===2FeO42-+5H2O+3Cl- 2分
(4) 5H2S +8ClO2 +4H2O === 18H+ +5SO42- +8Cl- 2分
(5)H3PO4 (6)1.0 2分 (7) 2.63 2分
![]() 18.(14分,除有说明外,每空2分)
18.(14分,除有说明外,每空2分)
(1)①MnO2+4H++2Cl-===Mn2++Cl2↑+2H2O 2分
②MnO2+2e-+4H+===Mn2++2H2O 2分 ③MnO2氧化性减弱(1分)
④KCl固体(或浓/饱和溶液)(1分) MnSO4固体(或浓/饱和溶液)(1分)
(2)KCl>KBr>KI 2分(3)AgNO3或Ag2SO4 2分
(4)稀硫酸(1分) 、NaOH溶液 2分
19.(14分,除标注外每空2分)
(1) P (1分) 分子晶体 (1分)
(2)GeO2 +2OH-![]() GeO32- +H2O (3) 20-25
GeO32- +H2O (3) 20-25
(4) GeCl4在稀盐酸小易水解 (5)GeCl4+(2+n)H2O![]() GeO2·nH2O↓+4HCl
GeO2·nH2O↓+4HCl
(6)①I- ②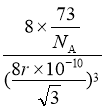
20.(14分)
(1)醚键、碳溴键 (2分)
(2) (2分)
(2分)
(3)取代反应 (1分)
(4)bd (2分)
(5)  (2分)
(2分)
(6)1∶2 (2分)
(7) C19H20O3 (1分)
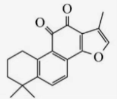 (2分)
(2分)
![]()
![]()
 2024山西三重教育联盟高三9月联考化学试题及答案解析
2024山西三重教育联盟高三9月联考化学试题及答案解析2024山西三重教育联盟高三9月联考化学试题及答案...
2023-09-20 2024新高考不选化学就废了吗 必须选化学吗
2024新高考不选化学就废了吗 必须选化学吗新高考如果不选化学,部分专业可能报考不了,但影响不...
2023-09-19 2024新高考不选化学就废了吗 必须要选吗
2024新高考不选化学就废了吗 必须要选吗2024新高考不选化学也没关系的,不选化学,部分专...
2023-09-19 新高考只选物理不选化学2024 必须一起选吗
新高考只选物理不选化学2024 必须一起选吗新高考选物理不一定要选化学。学生可以根据个人的情况...
2023-09-19 化学考50分赋分多少 如何赋分
化学考50分赋分多少 如何赋分化学考50分赋分不一定,得看情况来定分数。赋分一般...
2023-09-19 历史化学政治可以选什么专业 选科组合分析
历史化学政治可以选什么专业 选科组合分析历史化学政治组合能报的专业有人文社科类专业、管理类...
2023-09-19 化学竞赛省一有用吗 省级一等奖作用有哪些
化学竞赛省一有用吗 省级一等奖作用有哪些化学竞赛省一有用。全国高中学生化学竞赛(省级赛区)...
2023-09-18 重庆金太阳2024高三联考化学试题及答案解析
重庆金太阳2024高三联考化学试题及答案解析重庆金太阳2024高三联考化学试题及答案解析
2023-09-17 9年级化学课本出现高“猛”酸钾 具体什么情况
9年级化学课本出现高“猛”酸钾 具体什么情况江苏一本九年级化学课本中的印刷错误引发了广大网友们...
2023-09-17 2024济南高三开学考化学试题及答案解析
2024济南高三开学考化学试题及答案解析2024济南高三开学考化学试题及答案解析
2023-09-16 2024江西南昌高三零模测试化学试题及答案解析
2024江西南昌高三零模测试化学试题及答案解析2024江西南昌高三零模测试化学试题及答案解析
2023-09-15 2024年9月江西金太阳高三第一次联考化学试题及答案解析
2024年9月江西金太阳高三第一次联考化学试题及答案解析2024年9月江西金太阳高三第一次联考化学试题及答...
2023-09-14 衡水金卷2024新高三摸底联考化学试题及答案解析
衡水金卷2024新高三摸底联考化学试题及答案解析衡水金卷2024新高三摸底联考化学试题及答案解析
2023-09-14 2024江苏南京高三零模考试化学试题及答案解析
2024江苏南京高三零模考试化学试题及答案解析2024江苏南京高三零模考试化学试题及答案解析
2023-09-13 辽宁2024金太阳高三9月联考化学试题及答案解析
辽宁2024金太阳高三9月联考化学试题及答案解析辽宁2024金太阳高三9月联考化学试题及答案解析
2023-09-13
点击查看 高考试题 更多内容